
在本文中,格雷斯海姆(Gerresheimer)公司的高級(jí)醫(yī)學(xué)事務(wù)經(jīng)理 RezaAbedian 博士、全球市場經(jīng)理 MarieStockton 以及科學(xué)事務(wù)與應(yīng)用技術(shù)負(fù)責(zé)人 BerndZeiss 探討了玻璃體內(nèi)注射( IVI )的復(fù)雜性及尚未滿足的臨床需求,并闡釋了格雷斯海姆注射器技術(shù)如何助力克服這些挑戰(zhàn)。
通過玻璃體內(nèi)注射( IVI )將蛋白類液體藥物直接輸送至玻璃體,改變了視網(wǎng)膜疾病的治療方式。IVI 可以將精確濃度的藥物直接輸送到眼后段,并且最大限度地減少全身副作用¹。雖然 IVI 在臨床上療效顯著,但仍面臨諸多挑戰(zhàn),包括注射劑量的精確性和操作的可重復(fù)性、操作流程的效率不高以及患者的安全性等問題²。為此,格雷斯海姆通過深入研究與測試,開發(fā)了針對(duì) IVI 優(yōu)化的注射器技術(shù),并持續(xù)投入創(chuàng)新以便更好地服務(wù)臨床需求,惠及患者健康。
IVI 在視網(wǎng)膜疾病治療中的核心作用
玻璃體內(nèi)注射(IVIs)已成為注射抗血管內(nèi)皮生長因子(anti-VEGF)藥物、皮質(zhì)類固醇和抗生素以治療視網(wǎng)膜疾病的標(biāo)準(zhǔn)手段。這一方式對(duì)于治療多種嚴(yán)重眼部疾病至關(guān)重要。濕性年齡相關(guān)性黃斑變性(AMD)是導(dǎo)致老年人視力喪失的主要原因之一,通過anti-VEGF治療可抑制VEGF活性,減少新生血管形成和液體滲漏,從而穩(wěn)定甚至改善許多患者的視力。同樣,糖尿病性黃斑水腫、糖尿病視網(wǎng)膜病變和視網(wǎng)膜靜脈阻塞等疾病也常通過玻璃體內(nèi)注射來減輕黃斑水腫,恢復(fù)或維持患者的視力。隨著糖尿病患者數(shù)量的增加以及大多數(shù)地區(qū)人口老齡化的加劇,玻璃體內(nèi)注射(IVIs)的需求量逐年上升,對(duì)于高效且有效的 IVI 治療的需求也隨之增長。
劑量準(zhǔn)確性:注射器與操作經(jīng)驗(yàn)雙重挑戰(zhàn)
IVI 面臨的挑戰(zhàn):確保劑量與注射體積的精確性以及操作的可重復(fù)性
由于玻璃體內(nèi)注射體積通常為20 -100 微升(μL),因此精準(zhǔn)且可重復(fù)的微升級(jí)別給藥至關(guān)重要。其中所使用的注射器是一個(gè)關(guān)鍵因素,但醫(yī)生的操作經(jīng)驗(yàn)也極大影響劑量準(zhǔn)確性³。注射過程中,推動(dòng)活塞以排出氣泡并完成注射器預(yù)充的操作,推注幅度是否準(zhǔn)確也會(huì)影響最終注射的劑量。這一點(diǎn)在注射劑量非常小時(shí)尤其具有挑戰(zhàn)性,因?yàn)橥茥U只能移動(dòng)一個(gè)極小的距離。此外,傳統(tǒng)注射器僅依賴外筒的視覺標(biāo)記(如黑色環(huán))定位劑量,進(jìn)一步增加誤差風(fēng)險(xiǎn)。一項(xiàng)評(píng)估800次注射的研究顯示,使用預(yù)灌封注射器(PFS)時(shí),22%的注射劑量偏差超過目標(biāo)體積(0.05mL)的20%?。
患者安全與治療效果
如前文所述,在注射小劑量藥物時(shí),精確給藥是一個(gè)挑戰(zhàn)。如果過量注射,可能會(huì)引發(fā)諸如眼內(nèi)炎癥、出血以及眼內(nèi)壓升高(IOP),也被稱為術(shù)后眼壓升高? 等并發(fā)癥。對(duì)于如濕性年齡相關(guān)性黃斑變性(AMD)等需要反復(fù)注射治療的慢性疾病,這些風(fēng)險(xiǎn)會(huì)進(jìn)一步增加。
另一方面,由于操作技術(shù)的差異,以及某些注射器存在較大的殘留空間(dead space),可能導(dǎo)致給藥劑量不足,而劑量不足可能降低治療效果,同時(shí)也造成昂貴藥物的浪費(fèi)。
另一個(gè)值得關(guān)注的問題是在注射過程中微粒進(jìn)入玻璃體內(nèi)。這一問題在治療需要反復(fù)注射的疾病中尤為重要,因?yàn)殡S著時(shí)間的推移,這些微粒可能在眼內(nèi)積聚(通常被稱為“飛蚊癥”),并可能影響視力。因此,《美國藥典》(USP <789>)和《歐洲藥典》(Ph Eur 2.9.19),對(duì)微粒數(shù)量有嚴(yán)格的監(jiān)管要求。注射時(shí)進(jìn)入玻璃體的微粒主要來自潤滑注射器內(nèi)壁的硅油、藥物處方本身、給藥過程以及密封膠塞。
將藥物從西林瓶轉(zhuǎn)移至普通硅化注射器的過程會(huì)顯著增加微粒污染的風(fēng)險(xiǎn)。而使用預(yù)灌封注射器(PFS)則能夠顯著降低殘留體積和微粒負(fù)荷,同時(shí)大幅減少污染風(fēng)險(xiǎn),從而降低眼內(nèi)炎的發(fā)生6,7。
操作效率與臨床負(fù)擔(dān)
目前 IVI 的操作往往較為耗時(shí),這在臨床環(huán)境中增加了成本并加重了資源負(fù)擔(dān)。如果治療藥物是以西林瓶形式儲(chǔ)存的,則在給藥前必須先將其轉(zhuǎn)移至注射器中,并按照患者所需的劑量進(jìn)行預(yù)充。這一過程不僅增加了人為操作失誤的可能性,也降低了操作的整體效率。隨著需要通過 IVI 治療的視網(wǎng)膜疾病患病率不斷增加,優(yōu)化流程提高效率對(duì)降低醫(yī)療成本與資源消耗尤為重要。
應(yīng)對(duì) IVI 挑戰(zhàn)的解決方案
格雷斯海姆作為全球的眼科包裝解決方案提供商,致力于持續(xù)研發(fā)創(chuàng)新,以應(yīng)對(duì)該領(lǐng)域尚未滿足需求的解決方案。
預(yù)灌封注射器(PFS)(圖1)是優(yōu)化注射流程的第一步。在此方式下,藥物已按正確的體積和劑量濃度預(yù)先填充至玻璃或環(huán)烯烴聚合物(COP)注射器中,無需再從西林瓶轉(zhuǎn)移至注射器。使用預(yù)灌封注射器不僅簡化了操作流程,還能減少潛在的誤差和污染的可能性。最重要的是,近期研究表明,采用預(yù)灌封注射器(PFS)進(jìn)行玻璃體內(nèi)注射(IVIs)可顯著降低眼內(nèi)炎的發(fā)生率?。

圖 1:0.5mL玻璃注射器(含魯爾鎖接頭),可選BOS烘烤硅化或無硅油設(shè)計(jì),支持(RTF®)免洗免滅配置與多種劑量標(biāo)記選項(xiàng)。
BOS烘烤硅化注射器
與適用于多種藥物和應(yīng)用的傳統(tǒng)噴涂硅油工藝不同,只有特殊的低微粒硅化工藝(如烘烤硅化工藝,簡稱BOS)才能形成更薄、更均勻且更穩(wěn)定的硅油層,這是因?yàn)楣栌屯ㄟ^氫鍵與部分共價(jià)鍵結(jié)合在了表面。這大大降低了硅油在藥物保質(zhì)期內(nèi)以及注射過程中遷移到藥物中的風(fēng)險(xiǎn),從而避免可能引起聚集、藥物相互作用以及微粒遷移至玻璃體內(nèi)的風(fēng)險(xiǎn)。BOS 已經(jīng)證明能夠滿足 USP <789> 對(duì)眼科藥物微粒要求。
無硅油注射器
格雷斯海姆推出的無硅油注射器標(biāo)志著注射器技術(shù)的一項(xiàng)重大創(chuàng)新。這類注射器摒棄含硅潤滑劑,從而避免硅油導(dǎo)致的微粒形成,因?yàn)楣栌涂赡茉诓Aw內(nèi)注射前誘發(fā)蛋白質(zhì)聚集。注射器中硅油的釋放可能加劇這一過程,并導(dǎo)致制劑中蛋白質(zhì)聚集的微粒增多?。因此,去除硅油有助于提高包材與敏感蛋白類藥物的相容性,降低聚集風(fēng)險(xiǎn)?。
經(jīng)驗(yàn)證的注射器性能
在一項(xiàng)評(píng)估烘烤硅化(BOS)注射器和無硅油注射器性能的研究中,發(fā)現(xiàn)其微粒水平顯著低于《美國藥典》<789>的要求,這證實(shí)了它們適用于眼科應(yīng)用(圖 2)。測試過程中使用了注射用水,分別對(duì)玻璃和環(huán)烯烴聚合物(COP)材質(zhì)的注射器在實(shí)時(shí)和加速儲(chǔ)存條件下進(jìn)行了評(píng)估。結(jié)果顯示,在所有測試條件下,微粒數(shù)量均保持在較低水平。對(duì) BOS 和不含硅油注射器的比較分析表明,這兩種選擇都安全有效,并符合 USP <789> 標(biāo)準(zhǔn)要求。
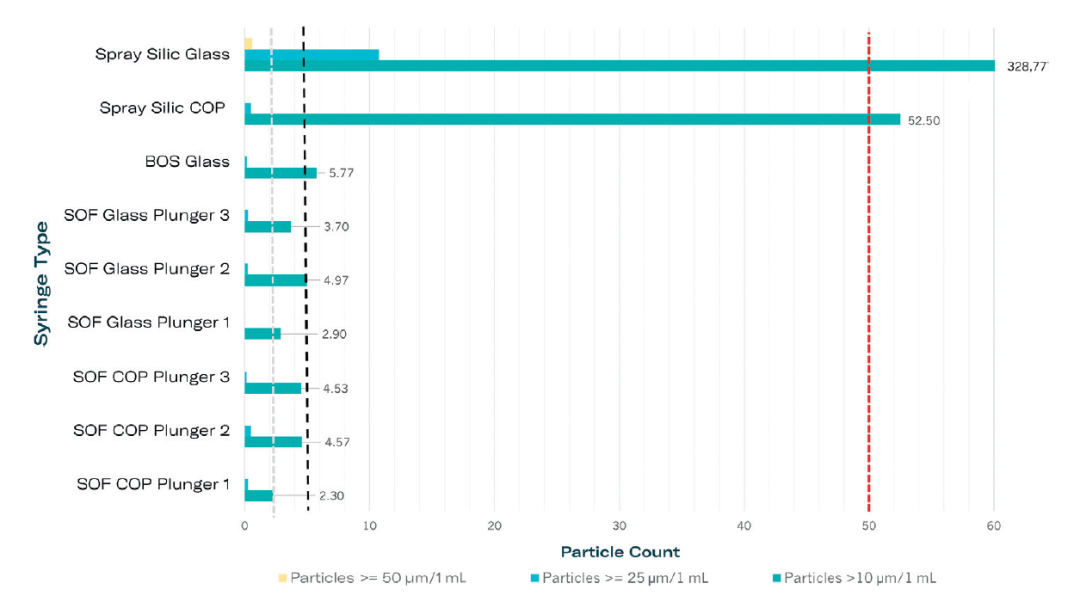
圖 2:根據(jù) USP <789> 標(biāo)準(zhǔn),對(duì)不含硅油的 1 毫升注射器以及經(jīng)過硅化處理的系統(tǒng)進(jìn)行了微粒測量。圖中虛線分別表示符合 USP <789> 標(biāo)準(zhǔn)的三類微粒限值。所有測試用注射器均填充了注射用水。具體說明如下:COP/Glass 表示注射器材料;Spray Silic 表示噴涂硅油處理;BOS 表示烘烤硅化處理,且每種材料均配備帶有涂層的膠塞。此外,SOF(無硅油注射器)與膠塞1-3相關(guān)的注射器,其特征在于采用不同類型的膠塞設(shè)計(jì)。
劑量準(zhǔn)確性
為了精確輸送微升級(jí)劑量,需要使用容量為0.5 mL或1 mL的預(yù)灌封注射器(PFS),因其具有較小的內(nèi)徑。玻璃注射器內(nèi)徑公差可設(shè)定為±0.1 mm,甚至可達(dá)±0.05 mm,以滿足最嚴(yán)苛的要求。而環(huán)烯烴聚合物(COP)注射器采用注塑成型工藝,這意味著其尺寸公差更小,從而實(shí)現(xiàn)更高的劑量體積準(zhǔn)確性。
劑量標(biāo)記是眼科專家在進(jìn)行此類小劑量注射時(shí)的重要視覺輔助工具。這種可視劑量標(biāo)記有助于準(zhǔn)確判斷膠塞的停止位置,從而實(shí)現(xiàn)對(duì)患者所需劑量的精確注射。格雷斯海姆在其玻璃注射器生產(chǎn)工廠中采用了先進(jìn)的視覺檢測系統(tǒng),確保注射器上的劑量標(biāo)記準(zhǔn)確無誤,誤差范圍低至± 0.25 mm。
啟動(dòng)力與滑動(dòng)力
啟動(dòng)力和滑動(dòng)力(BLGF)測試進(jìn)一步驗(yàn)證了這些注射器用于玻璃體內(nèi)注射(IVIs)的適用性。在經(jīng)過三個(gè)月的加速老化測試(相當(dāng)于實(shí)際儲(chǔ)存三年)后,所有無硅油玻璃注射器的BLGF值均低于20 N,表明出了優(yōu)異的使用性能。滑動(dòng)力未受老化影響,突顯該注射器系統(tǒng)的穩(wěn)定性和可靠性(圖3)。
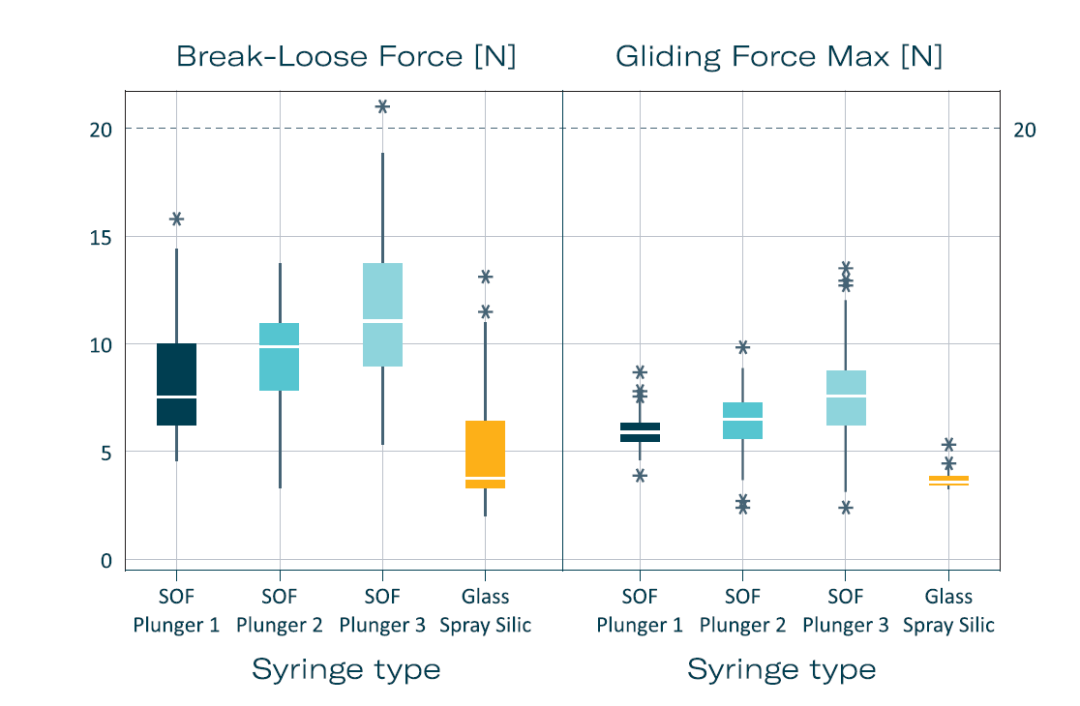
圖 3:無硅油注射器與噴涂硅油注射器啟動(dòng)力滑動(dòng)力的比較。推注速度:270 毫米/分鐘。每個(gè)注射器均為 1 毫升細(xì)長,配備普通璧厚27G針頭,并填充注射用水。每項(xiàng)測試均平行測試160次:總共 [T0(灌注后3天),T1(3個(gè)月),T1加速(根據(jù) ICH 標(biāo)準(zhǔn)加速老化 3個(gè)月),T2加速(根據(jù) ICH 標(biāo)準(zhǔn)加速老化 6個(gè)月),T2(6個(gè)月)]。注釋:SOF with plungers 1–3:無硅油注射器,帶有三種來自不同廠家的特殊膠塞;Glass Spray Sili:0.5mg噴涂硅油玻璃注射器+覆膜膠塞。
滿足患者與臨床醫(yī)生的需求
在推動(dòng)創(chuàng)新的同時(shí),格雷斯海姆始終將提升患者和臨床醫(yī)生在玻璃體內(nèi)注射過程中的體驗(yàn)置于首位。通過減少甚至消除硅油顆粒,并確保預(yù)灌封注射器(PFS)注射順暢,公司提供的解決方案顯著提升了患者安全性。對(duì)臨床醫(yī)生而言,采用預(yù)灌封注射器簡化了準(zhǔn)備工作,縮短了操作時(shí)間,同時(shí)降低了給藥誤差和污染風(fēng)險(xiǎn)。這不僅大幅提升了工作流程的效率,也讓醫(yī)護(hù)人員(HCPs)能夠更專注于患者護(hù)理。
IVI 操作還能進(jìn)一步優(yōu)化嗎?
格雷斯海姆的注射器已經(jīng)大幅改善了玻璃體內(nèi)注射所面臨的挑戰(zhàn)。然而,眼科專家的判斷力、操作技巧和臨床經(jīng)驗(yàn),仍會(huì)對(duì)微升級(jí)別給藥的準(zhǔn)確性、可重復(fù)性以及患者舒適度產(chǎn)生影響10。這些因素在處理極小劑量時(shí)尤為關(guān)鍵——例如,治療早產(chǎn)兒視網(wǎng)膜病變時(shí),注射劑量可能低至 20 μL。在此類情況下,患者的安全性和舒適性更需重點(diǎn)關(guān)注。此外,還需考慮藥物的治療窗口:若治療窗口較窄,劑量過高或不足可能對(duì)治療效果產(chǎn)生更大影響。因此,格雷斯海姆發(fā)起了一項(xiàng)創(chuàng)新項(xiàng)目,旨在開發(fā)一種輔助注射裝置,以進(jìn)一步優(yōu)化玻璃體內(nèi)注射的精準(zhǔn)度、安全性和操作效率,更好地滿足患者和醫(yī)護(hù)人員的需求。
開展以用戶為中心的研究
以用戶為中心是格雷斯海姆開發(fā)流程的核心理念。每當(dāng)發(fā)現(xiàn)潛在的未被滿足的需求時(shí),公司首先會(huì)開展用戶偏好研究。在本案例中,通過在線問卷與面對(duì)面訪談相結(jié)合的方式,對(duì)25位視網(wǎng)膜專家進(jìn)行深入調(diào)研,旨在確認(rèn)臨床實(shí)踐中的挑戰(zhàn)并挖掘更多未被滿足的需求11。隨后,研究團(tuán)隊(duì)還對(duì)五位國際權(quán)威意見領(lǐng)袖(KOLs)進(jìn)行了深度訪談。研究結(jié)果表明,操作便捷性、針頭定位的精確性,以及給藥劑量的準(zhǔn)確性與一致性,被醫(yī)護(hù)人員視為關(guān)鍵因素。
初步概念測試
基于初步研究,團(tuán)隊(duì)提出了多個(gè)設(shè)想的裝置概念,重點(diǎn)聚焦于用戶尚未被滿足的需求,例如操作特性以及預(yù)定注射劑量的準(zhǔn)確性。隨后,對(duì)這些裝置概念進(jìn)行了驗(yàn)證測試和用戶體驗(yàn)驗(yàn)證。采用定性評(píng)估與統(tǒng)計(jì)分析相結(jié)合的方法,確定使用輔助裝置的預(yù)灌封注射器注射與手動(dòng)注射進(jìn)行常規(guī)治療的結(jié)果是否存在顯著差異。結(jié)果顯示,與手動(dòng)注射相比,裝置輔助注射減少了輸送量的可變性,劑量一致性顯著優(yōu)于手動(dòng)操作(圖4)。

圖4:注射20、50和80μL樣本使用輔助裝置的預(yù)灌封注射器注射與手動(dòng)注射的方差相等性檢驗(yàn)的結(jié)果。標(biāo)準(zhǔn)差的多重比較區(qū)間,α = 0.05。
原型裝置的深度測試
隨后,成功研制出注射輔助裝置的升級(jí)版原型,并對(duì)其在20、50和80 μL目標(biāo)劑量下的注射準(zhǔn)確性與重復(fù)性進(jìn)行嚴(yán)格測試。五名使用者分別使用帶有注射輔助裝置原型的預(yù)灌封注射器(PFS),以及采用視覺劑量標(biāo)記的預(yù)灌封注射器作為當(dāng)前IVI 的標(biāo)準(zhǔn)操作方法,對(duì)每個(gè)目標(biāo)劑量體積進(jìn)行了注射(每位使用者對(duì)每個(gè)目標(biāo)劑量注射10次)(圖5)。

圖 5:注射20、50和80μL樣本使用輔助裝置的預(yù)灌封注射器注射與手動(dòng)注射的劑量分布直方圖。
結(jié)果表明,使用該注射裝置時(shí),注射量的波動(dòng)性比手動(dòng)注射時(shí)要小。統(tǒng)計(jì)分析證實(shí),借助輔助裝置的注射具有更優(yōu)的一致性。該設(shè)備的潛在優(yōu)勢是多方面的:通過改進(jìn)注射過程中的關(guān)鍵環(huán)節(jié),注射輔助裝置可通過減少劑量誤差來提高患者安全性,同時(shí)還有望縮短操作時(shí)間,使患者和臨床醫(yī)生雙雙受益。
格雷斯海姆致力于與該領(lǐng)域?qū)<揖o密合作,以確保最終產(chǎn)品符合最高的安全性和有效性標(biāo)準(zhǔn)12。未來開發(fā)步驟包括進(jìn)一步測試,以優(yōu)化裝置設(shè)計(jì)并驗(yàn)證其在實(shí)際環(huán)境中的性能表現(xiàn)。該研究項(xiàng)目目前仍在進(jìn)行中,下一階段的研究成果也已獲采納。
結(jié)論
IVI 是眼科十分重要的治療手段,但在確保給藥的精確性、安全性和高效性方面仍面臨挑戰(zhàn),尤其是在要求較高的視網(wǎng)膜疾病治療中。格雷斯海姆(Gerresheimer)始終致力于以患者和用戶為中心的創(chuàng)新,不斷識(shí)別并滿足尚未解決的需求。通過這一方式,公司始終走在玻璃體內(nèi)藥物遞送解決方案的前沿,助力醫(yī)療專業(yè)人員,為患者實(shí)現(xiàn)最佳治療效果。
文獻(xiàn)
1. Angermann R et al, “Changes in systemic levels of vascular endothelial growth factor after intravitreal injection of aflibercept or brolucizumab for neovascular age-related macular degeneration”. Retina, 2022, Vol 42(3), pp 503–510.
2. Agra LM et al, “Accuracy, Precision, and Residual Volume of Commonly Used Syringes for Intravitreal Injections and the Impact on Intraocular Pressure”. Ophthalmol Retina, 2023, Vol 7(10), pp 892–900.
3. Meyer CH et al, “Routes for Drug Delivery to the Eye and Retina: Intravitreal Injections”. Dev Ophthalmol, 2016, Vol 55, pp 63–70.
4. Raju JR and Weinberg DV, “Accuracy and precision of intraocular injection volume”. Am J Ophthalmol, 2002, Vol 133(4), pp 564–566.
5. Dounce S et al, “Particulate Matter from Syringes Used for Intravitreal Injections”. Retina, 2020, Vol 41(4), pp 827–833.
6. Levin AM et al, “Intraocular Pressure Elevation Following Intravitreal Anti-VEGF Injections: Short- and Long-term Considerations”. J Glaucoma, 2021, Vol 30 (12), pp 1019–1026.
7. Louis AM et al, “Impact of Prefilled Syringes and Masking on Postintravitreal Injection Endophthalmitis”. J Vitreoretin Dis, 2023, Vol 7(5), pp 382–388.
8. Melo GB, “Potential Implications of Silicone Oil From Syringes.” Retinal Physician, 2022, Vol 19, pp 40–42.
9. Schargus M et al, “Contamination of anti-VEGF drugs for intravitreal injection: How do repackaging and newly developed syringes affect the amount of silicone oil droplets and protein aggregates?” Retina, 2018, Vol 38(10), pp 2088–2095.
10. Shetty G, Zeiss B, “Microlitre Dosing with Prefillable Syringes – When Does a Device Make Sense?”, ONdrugDelivery, Issue 97 (May 2019), pp 28–31.
11. Abedian R et al, “Facilitating microliter dosing for intravitreal application: A User-Preference Study”. Gerresheimer, Oct 2023.
12. Abedian R et al, “A User-preference Study on an Ophthalmic Injection Device to Facilitate Microliter Dosing for Intravitreal Injections”, Proceedings of PDA Universe of PFS and Injection devices, Oct 2024.







